Il 5 luglio, Novo Nordisk ha lanciato in Cina uno studio clinico di fase III sull'iniezione di CagriSema, il cui scopo è confrontare la sicurezza e l'efficacia dell'iniezione di CagriSema con semeglutide nei pazienti obesi e in sovrappeso in Cina.
CagriSema iniezione è una terapia combinata a lunga durata d'azione in fase di sviluppo da parte di Novo Nordisk, i cui componenti principali sono smeglutide, agonista del recettore del GLP-1 (peptide-1 simile al glucagone), e cagrilintide, un analogo dell'amilina a lunga durata d'azione.L'iniezione di CagriSema può essere somministrata per via sottocutanea una volta alla settimana.
L'obiettivo primario era confrontare CagriSema (2,4 mg/2,4 mg) con semeglutide o placebo una volta alla settimana per via sottocutanea.Novo Nordisk ha annunciato i risultati di uno studio su CagriSema per il trattamento del diabete di stadio 2, che ha dimostrato che l'effetto ipoglicemizzante di CagriSema è migliore di quello di semeglutide e quasi il 90% dei soggetti ha raggiunto l'obiettivo di HbA1c.
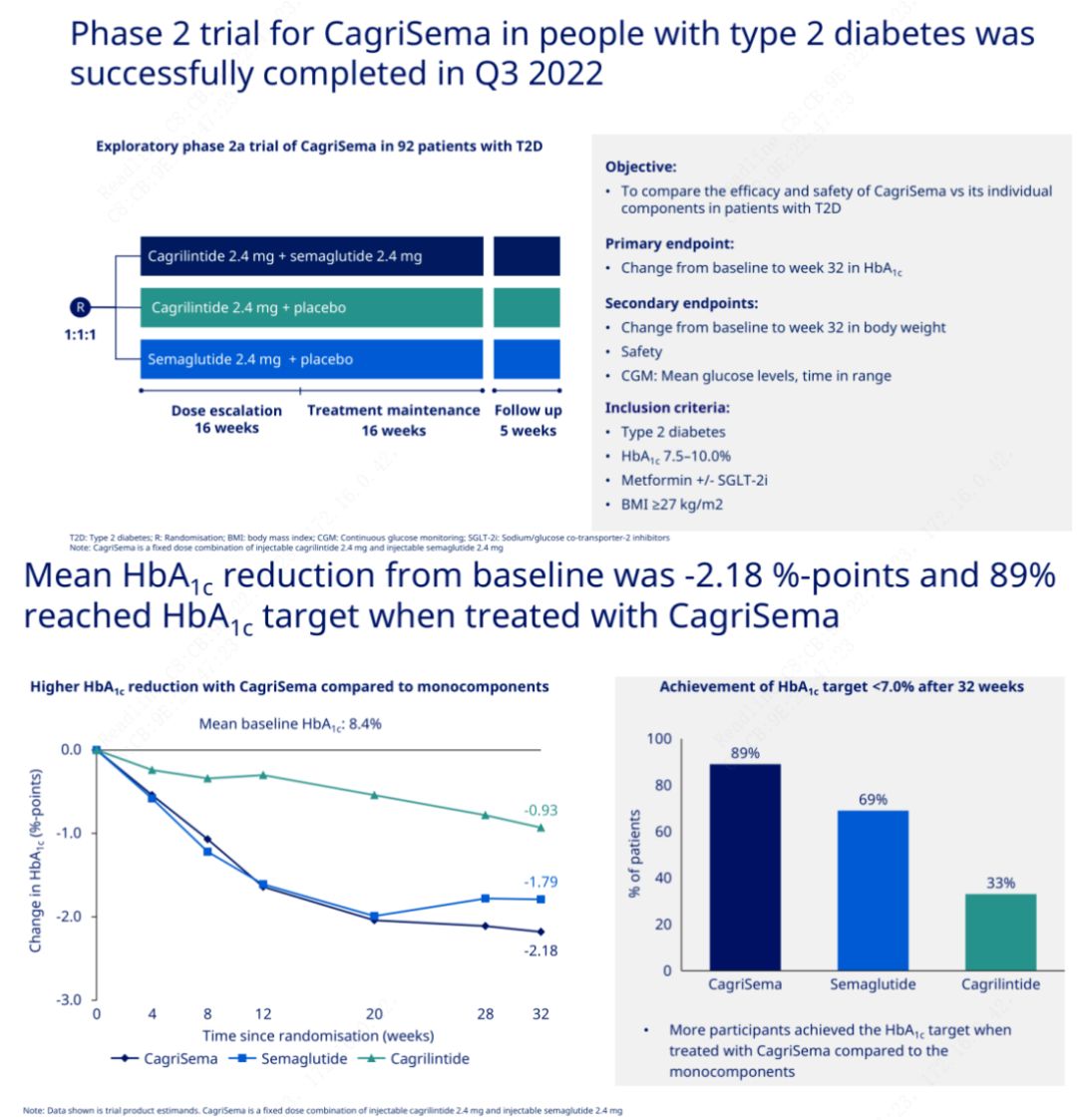
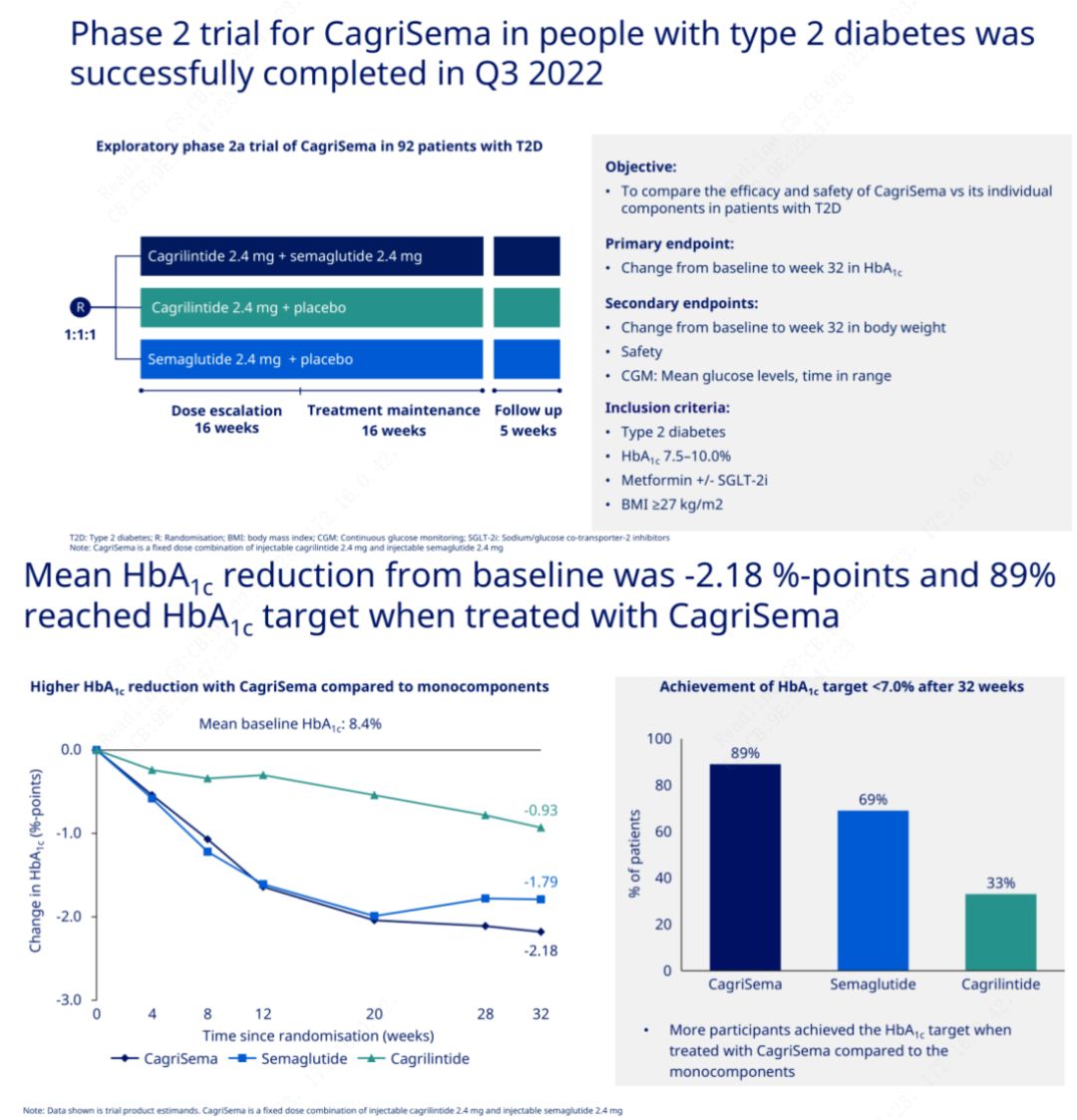
I dati hanno mostrato che oltre al significativo effetto ipoglicemizzante, in termini di perdita di peso, l’iniezione di CagriSema ha sovraperformato significativamente semeglutide (5,1%) e cagrilintide (8,1%) con una perdita di peso del 15,6%.
L'innovativo farmaco Tirzepatide è il primo agonista settimanale dei recettori GIP/GLP-1 approvato al mondo.Combina gli effetti di due incretine in un'unica molecola che viene iniettata una volta alla settimana e rappresenta una nuova classe di trattamenti per il diabete di tipo 2.La tirzepatide è stata approvata dalla Food and Drug Administration (FDA) statunitense nel maggio 2022 per migliorare il controllo glicemico (su base dietetica ed esercizio fisico) negli adulti con diabete di tipo 2 ed è attualmente approvata nell'Unione Europea, in Giappone e in altri paesi.
Il 5 luglio, Eli Lilly ha annunciato uno studio di fase III SURPASS-CN-MONO sulla piattaforma di registrazione degli studi clinici sui farmaci e di divulgazione delle informazioni per il trattamento dei pazienti affetti da diabete di tipo 2.SURPASS-CN-MONO è uno studio di fase III randomizzato, in doppio cieco, controllato con placebo, progettato per valutare l'efficacia e la sicurezza della monoterapia con tirzepatide rispetto al placebo nelle persone con diabete di tipo 2.Lo studio prevedeva di includere 200 pazienti con diabete di tipo 2 che non assumevano alcun farmaco antidiabetico nei 90 giorni precedenti la Visita 1 (ad eccezione di alcune situazioni cliniche, come malattia acuta, ospedalizzazione o chirurgia elettiva, a breve termine (≤14 giorni) uso di insulina).
Si prevede che il diabete di tipo 2 venga approvato quest’anno
Il mese scorso, i risultati di uno studio SURPASS-AP-Combo sono stati pubblicati il 25 maggio sulla rivista di successo Nature Medicine.I risultati hanno mostrato che, rispetto all’insulina glargine, Tirzepatide ha mostrato una migliore riduzione dell’HbA1c e del peso nella popolazione di pazienti affetti da diabete di tipo 2 nella regione Asia-Pacifico (principalmente Cina): riduzione dell’HbA1c fino al 2,49% e riduzione del peso fino a 7,2 kg. (9,4%) a 40 settimane di trattamento, il miglioramento significativo dei lipidi nel sangue e della pressione sanguigna, e la sicurezza e la tollerabilità complessive erano buone.
Lo studio clinico di Fase 3 di SURPASS-AP-Combo è il primo studio su Tirzepatide condotto principalmente su pazienti cinesi con diabete di tipo 2, guidato dal professor Ji Linong dell'Ospedale popolare dell'Università di Pechino.SURPASS-AP-Combo è coerente con i risultati della serie di ricerca globale SURPASS, che dimostra ulteriormente che la fisiopatologia del diabete nei pazienti cinesi è coerente con quella dei pazienti globali, che costituisce la base per la ricerca e lo sviluppo simultanei di nuovi farmaci in Cina e nel mondo, e fornisce anche un solido supporto empirico per dare ai pazienti cinesi l’opportunità di utilizzare i più recenti farmaci per il trattamento del diabete e la loro applicazione clinica in Cina il prima possibile.
Orario di pubblicazione: 18 settembre 2023

